2024年10月1日,我校生命科学学院张水军教授课题组在《hLife》杂志发表了题为《High-resolution crystal structure of human coronavirus HKU1 receptor binding domain bound to TMPRSS2 receptor》(人冠状病毒HKU1受体结合域与TMPRSS2受体结合的高分辨率晶体结构)的研究论文,报道了人冠状病毒HKU1受体识别机制方面的研究成果。

人类冠状病毒HKU1(HCoV-HKU1)是一种可感染动物和人类的单链RNA包膜病毒,与SARS-CoV-2同属β冠状病毒。HKU1于2005年在香港首次被发现,在成年人中可能仅导致普通感冒,但在儿童、老年人或免疫功能低下的患者中可能导致严重肺炎。目前HKU1已被鉴定出三种主要病毒基因型:HKU1-A、HKU1-B和HKU1-C。多年以来,HKU1入侵宿主的蛋白质受体一直未发现。进入21世纪后,冠状病毒接连引发全球疫情,严重威胁人类的生命和健康。解析人类冠状病毒与宿主识别的分子机制,对于理解病毒的感染、致病机制以及研发抗病毒药物和疫苗具有重要意义。
2023年,法国科学家Olivier Schwartz等1鉴定出TMPRSS2为HKU1病毒入侵细胞的受体。基于此研究,张教授课题组解析了HKU1A刺突蛋白(S蛋白)受体结合区(RBD)与人跨膜丝氨酸蛋白酶(TMPRSS2)的复合物晶体结构。发现HKU1A RBD 的 R517 和 W515 对于与受体的结合至关重要。R517 与 TMPRSS2 V415 形成氢键,还与 TMPRSS2 的 Y414、Y469 和 R470 之间存在范德华力,W515 与 TMPRSS2 的 V415 和 D417 之间存在范德华力。
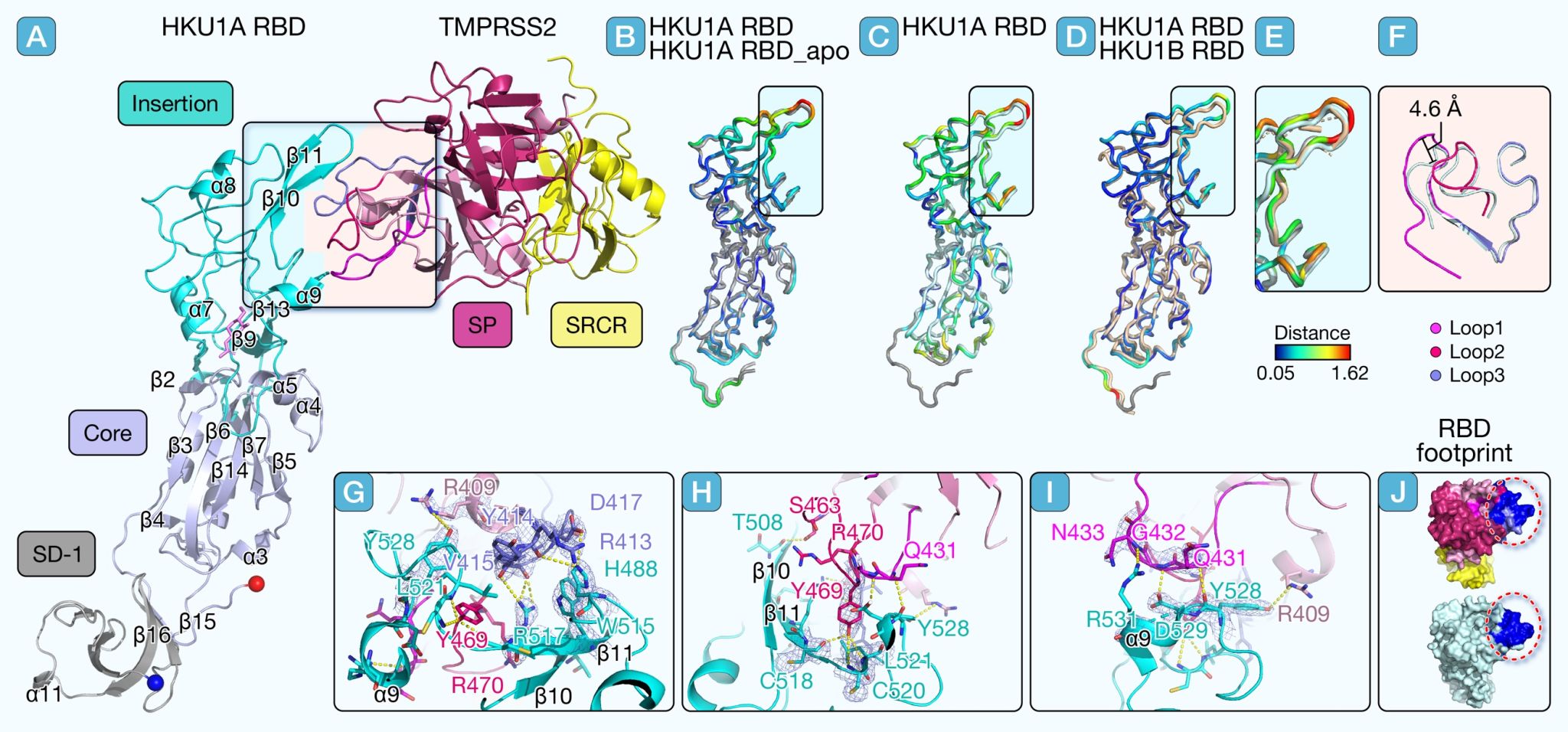
图1 HKU1A RBD与TMPRSS2复合物晶体结构示意图
在张教授课题组的结构中,HKU1A RBD 结合 TMPRSS2 的方向显示出与最近解析的其他复合物结构有显著差异。与HKU1A RBD-TMPRSS2复合物的冷冻电镜结构(PDB: 8VGT)和HKU1B RBD-TMPRSS2复合物的晶体结构(PDB: 8S0M)相比,HKU1A RBD分别旋转了6.4°和13.7°,表明 HCoV-HKU1受体结合的可塑性和复杂性。
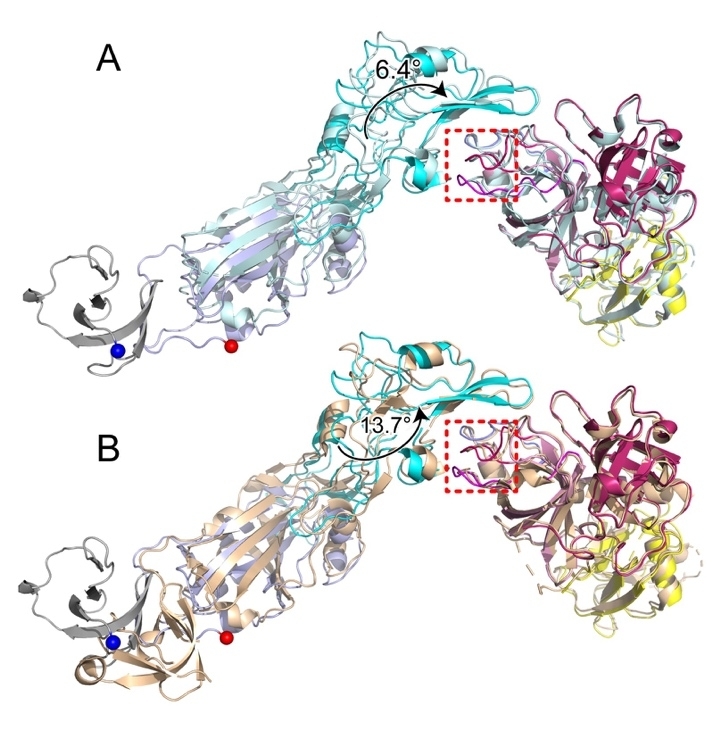
图2. 不同复合物中HKU1 RBD结合TMPRSS2的方向比较示意图
我校生科院张水军教授、徐颖副教授和江苏省农业科学院兽医研究所陈蓉助理研究员为论文的共同通讯作者。生科院博士研究生王炜为论文的第一作者。该研究得到了国家自然科学基金、江苏省自然科学基金和中央高校基本业务费等项目的资助。
参考文献
1.Saunders, N., Fernandez, I., Planchais, C., Michel, V., Rajah, M.M., Baquero Salazar, E., Postal, J., Porrot, F., Guivel-Benhassine, F., Blanc, C., et al. (2023). TMPRSS2 is a functional receptor for human coronavirus HKU1. Nature 624, 207-214. 10.1038/s41586-023-06761-7.
论文链接:https://www.sciencedirect.com/science/article/pii/S294992832400083X
